
一、法律法規(guī)
根據(jù)《Act on Securing Quality, Efficacy and Safety of Products Including Pharmaceuticals and Medical Devices》(簡稱:《藥機(jī)法》),日本藥品和медицинское устройство的管理遵循這一法規(guī)。《藥機(jī)法》由原《藥事法》變更而來,其具體實(shí)施規(guī)定包括《藥機(jī)法實(shí)施令》、《QMS省令》以及其他相關(guān)公告和通知。
二、主管機(jī)關(guān)
日本藥品和醫(yī)療器械的管理主要由兩個主管機(jī)關(guān)負(fù)責(zé),即日本厚生勞動省(MHLW)和行政法人醫(yī)藥品醫(yī)療器械綜合機(jī)構(gòu)(PMDA)。
三、醫(yī)療器械分類
(1)一般醫(yī)療器械(ClassⅠ):由日本厚生勞動省大臣在聽取“藥事和食品衛(wèi)生審議會”的意見后進(jìn)行指定,這類醫(yī)療器械在出現(xiàn)副作用或功能損害時,對人的生命和健康影響的風(fēng)險較小。
(2)管理醫(yī)療器械(ClassⅡ):同樣由日本厚生勞動省大臣在聽取“藥事和食品衛(wèi)生審議會”的意見后進(jìn)行指定,這類醫(yī)療器械在出現(xiàn)副作用或功能損害時,有可能對人的生命和健康造成影響,因此需要進(jìn)行適當(dāng)?shù)墓芾怼?/p>
(3)高度管理的醫(yī)療器械(ClassⅢ、ClassⅣ):這類醫(yī)療器械在出現(xiàn)副作用或功能受損的情況下,會對人的生命和健康產(chǎn)生嚴(yán)重影響,因此必須進(jìn)行嚴(yán)格的管理。

四、醫(yī)療器械認(rèn)證模式和注冊審核流程
外國制造商如果打算將其設(shè)備出口到日本,必須在厚生勞動省進(jìn)行注冊備案,這個程序被稱為外國制造商注冊(FMR)。這一過程會遵循PMD Act& 第169號法令I(lǐng)S0 13485日本醫(yī)療器械注冊審核流程。
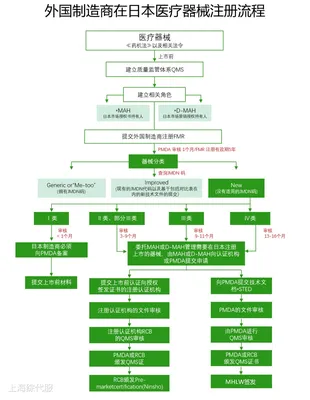
五、重點(diǎn)關(guān)注事項
(1)市場授權(quán)持有人(MAH)/市場營銷授權(quán)持有人(D-MAH):外國制造商必須在日本指定市場授權(quán)持有人,這是在日本銷售醫(yī)療器械的首要條件。
(2)STED摘要(注冊資料):需要包括產(chǎn)品規(guī)格、穩(wěn)定性和保質(zhì)期數(shù)據(jù)、性能測試數(shù)據(jù)、風(fēng)險分析、臨床數(shù)據(jù)等內(nèi)容。
(3)質(zhì)量管理體系(QMS)審核:由醫(yī)藥品與醫(yī)療器械局(PMDA)或某一家注冊過的認(rèn)證機(jī)構(gòu)(RCB)執(zhí)行,審核范圍包括制造銷售商、醫(yī)療器械的設(shè)計、生產(chǎn)制造等所有相關(guān)場所。
(4)多法規(guī)要求:進(jìn)口到日本市場的醫(yī)療器械產(chǎn)品還需要同時滿足其他法規(guī)的要求,如電安法、電波法等。


 Следите за обслуживанием клиентов WeChat
Следите за обслуживанием клиентов WeChat